2025年6月全球传染病疫苗研发动态
本月,全球及国内传染病疫苗领域动态频频,多家企业管线取得关键进展,同时美国疫苗监管政策出现重大调整。以下为本月重点信息汇总。
本月重点研发进展
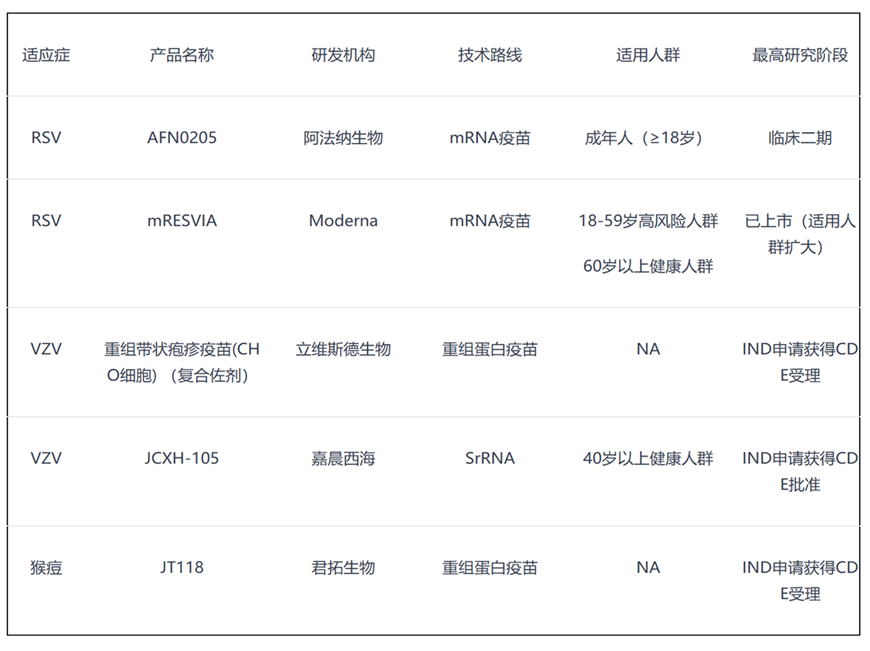
RSV 疫苗
阿法纳生物mRNA RSV疫苗(AFN0205)进入临床Ⅱ期
进展时点: 2025年6月12日
- 核心进展: 由阿法纳生物自主研发的RSV mRNA疫苗AFN0205正式启动II期临床试验。
- 行业地位: 成为国内首个进入II期临床的RSV mRNA疫苗,也是继新冠后首个进入该阶段的mRNA疫苗管线,标志着国内mRNA技术在非新冠领域的重大突破。
- 研发历程: 2024年7月获批临床,10月完成I期研究,进展迅速。

(图片来源于网络)
FDA批准Moderna的RSV疫苗mRESVIA扩展用于18-59岁高风险人群
进展时点: 2025年6月12日
- 核心进展: Moderna的RSV疫苗mRESVIA (mRNA-1345) 获FDA批准,将其适用人群从60岁以上老年人扩展至18-59岁的高风险成年人。
- 市场意义: 针对了患有慢性病的年轻成年人群体,该群体的RSV疾病负担和住院率与老年人相当,市场潜力巨大。Moderna计划在2025-2026呼吸道病毒季节向该人群提供疫苗。

(图片来源于网络)
三叶草生物启动RSV+hMPV±PIV3联合疫苗I期临床
进展时点: 2025年6月17日
- 核心进展: 三叶草生物宣布其呼吸道联合疫苗候选产品SCB-1022 (RSV+hMPV) 与 SCB-1033 (RSV+hMPV+PIV3) 正式启动I期临床试验。
- 技术平台: 该系列疫苗基于公司独有的Trimer-Tag(蛋白质三聚体化)技术平台开发。

(图片来源于网络)
VZV 疫苗 (带状疱疹)
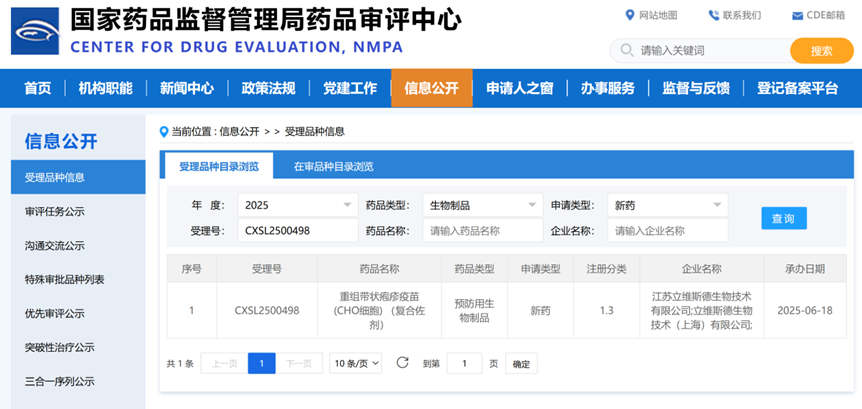
立维斯德生物重组带状疱疹疫苗IND申请获CDE受理
进展时点: 2025年6月18日
- 核心进展: 江苏立维斯德生物联合申报的重组带状疱疹疫苗(CHO细胞)(受理号:CXSL2500498)的IND申请已获CDE受理。
(图片来源于网络)
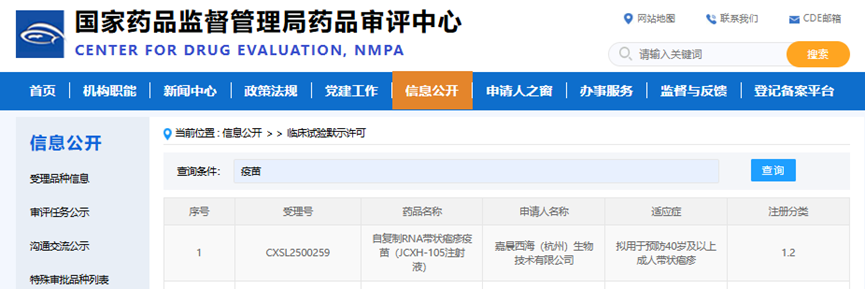
嘉晨西海自复制RNA(srRNA)带状疱疹疫苗获批临床
进展时点: CDE官网公示
- 核心进展: 嘉晨西海自主研发的自复制RNA(srRNA)带状疱疹疫苗JCXH-105在国内获批临床。该疫苗已于2024年7月在美国获批II期临床。
- 技术亮点: 与传统mRNA疫苗相比,srRNA技术具有自带佐剂效应,可刺激更强的细胞免疫,有望显著降低接种剂量、控制不良反应并大幅降低生产成本。
(图片来源于网络)
猴痘疫苗
君实生物子公司猴痘重组蛋白疫苗临床申请获受理
进展时点: 2025年6月12日
- 核心进展: 君实生物控股子公司君拓生物的猴痘重组蛋白疫苗JT118的临床试验申请获NMPA受理。
- 技术亮点: JT118是“二合一”重组蛋白疫苗,由猴痘病毒抗原A35和M1串联融合组成,分子量更大,更有利于激发免疫。临床前研究表明其具有显著保护作用且安全性良好。

(图片来源于网络)
重要行业政策
美国CDC调整疫苗专家团队,行业监管环境面临新变数
事件时点: 2025年6月9日
- 核心事件: 美国HHS部长宣布将解除免疫实践咨询委员会(ACIP)所有17名成员的职务,旨在“重建公众对疫苗科学的信心”。ACIP是为CDC提供疫苗接种建议的关键独立专家组。
- 政策影响: 此举预示着美国疫苗监管和推荐流程可能出现重大变化。新政策已对疫苗厂商构成威胁,例如FDA计划要求新冠加强针在健康成年人中进行更严格的安慰剂对照试验。
- 市场影响显著: 受政策及资金变动影响,Moderna已撤回其流感/新冠联合疫苗的申请。自去年6月以来,其股价已累计下跌超过80%。
文章目录
设备上扫码阅读
